การประเมินผลพฤติกรรมการกัดกร่อนของโลหะจากเส้นโค้งโพลาไรเซชัน (polarization curve)
การประเมินผลพฤติกรรมการกัดกร่อนของโลหะจากเส้นโค้งโพลาไรเซชัน (polarization curve)
>>โดย รุจีภรณ์ นาคขุนทด <<<
ศูนย์พัฒนาและวิเคราะห์สมบัติของวัสดุ
การกัดกร่อน (corrosion) ของโลหะสามารถเกิดขึ้นได้ตลอดเพราะเป็นพฤติกรรมธรรมชาติของโลหะ เมื่อเกิดขึ้นแล้วย่อมทำให้เกิดความเสียหายได้ทั้งในด้านทรัพย์สิน เศรษฐกิจ ถ้าเราสามารถประเมินความเสียหายจากการกัดกร่อนของโลหะได้ก่อนก็จะช่วยยับยั้งความเสียหายที่จะเกิดขึ้นในอนาคต การประเมินอัตราการกัดกร่อนของโลหะ สามารถทำได้หลายวิธี เช่น การทดสอบการกัดกร่อนโดยการผึ่งในบรรยากาศ การทดสอบความทนละอองน้ำเกลือ การใช้คูปองการกัดกร่อน การทดสอบด้วยเทคนิคเคมีไฟฟ้าโดยประเมินผลการกัดกร่อนจากเส้นโค้งโพลาไรเซชัน (polarization curve) ที่ช่วยลดปัญหาที่จะเกิดขึ้นได้
การทดสอบการกัดกร่อนของโลหะโดยเทคนิคเคมีไฟฟ้า (electrochemical technique) เป็นวิธีหนึ่งที่ช่วยประเมินอัตราการกัดกร่อนได้ดีและเร็ว และเป็นการจำลองการเกิดกระบวนการการกัดกร่อนของโลหะ โดยปกติแล้วการเกิดการกัดกร่อนเป็นปฏิกิริยาทางกายภาพของโลหะกับสภาพแวดล้อมรอบๆ โลหะ ซึ่งเกิดจากการถ่ายเทประจุไฟฟ้าหรือแลกเปลี่ยนอิเล็กตรอนในสารละลายของน้ำ เรียกว่า ปฏิกิริยาเคมีไฟฟ้า (electrochemical reaction) การเกิดปฏิกิริยาเคมีไฟฟ้าของการกัดกร่อนเป็นปฏิกิริยาออกซิเดชันและรีดักชัน เมื่อน้ำหรือสารละลายที่สัมผัสกับโลหะ หลักการของการทดสอบการกัดกร่อนโลหะโดยใช้เทคนิคทางเคมีไฟฟ้า คือการป้อนศักย์ไฟฟ้าเร่งการกัดกร่อน โดยใช้เครื่อง potentiostat/galvanostat ในสภาวะที่มีสารละลายอิเล็กโทรไลต์ ทำหน้าที่เป็นทางเดินของอิออน และเป็นการเชื่อมต่อเซลล์เคมีไฟฟ้า (electrochemical cell) ดังรูปที่ 1 ทำให้เราสามารถคำนวณหาอัตราการกัดกร่อนได้
เซลล์เคมีไฟฟ้าที่ใช้ในการทดสอบการกัดกร่อนของโลหะประกอบไปด้วย
- ขั้วทำงาน (working electrode หรือ specimen electrode) เป็นขั้วอาโนด ก็คือชิ้นตัวอย่างทดสอบ เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชันและให้อิเล็กตรอน
- ขั้วมาตรฐานอ้างอิง (standard reference electrode) เป็นขั้วแคโทด (cathode) ที่เกิดปฏิกิริยารีดักชันและรับอิเล็กตรอน เช่น SCE (saturated calomel electrode) หรือ Ag/AgCl ที่มีค่าศักย์ไฟฟ้าคงที่
- ขั้วอิเล็กโทรดกระแส (counter electrode) มักจะใช้โลหะที่เสถียร เช่น แพลตินัม หรือ กราไฟต์ หรือ เหล็กกล้าไร้สนิม
- สารละลายอิเล็กโทรไลต์ (electrolyte) ซึ่งเป็นทางเดินของอิออน
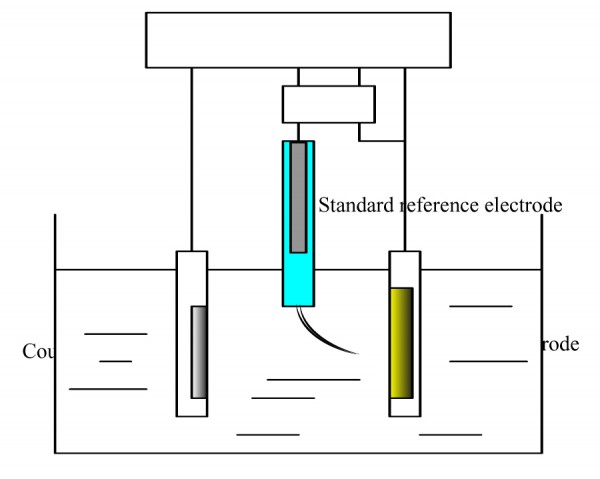
รูปที่ 1 เซลล์เคมีไฟฟ้าที่ใช้ในการทดสอบการกัดกร่อน
ค่าที่วัดได้จากการทดสอบ ได้เป็นเส้นโค้งโพลาไรเซชัน (polarization curve) ซึ่งแสดงความสัมพันธ์ระหว่างค่าศักย์ไฟฟ้าและค่ากระแสไฟฟ้า เมื่อป้อนศักย์ไฟฟ้าจนกระทั่งโลหะเริ่มเกิดการกัดกร่อนเราเรียกว่าค่าศักย์ไฟฟ้าการกัดกร่อน (corrosion potential, Ecorr) ที่จุดนี้ก็จะได้ค่าความหนาแน่นของกระแสไฟฟ้าการกัดกร่อน (corrosion current density, Icorr) ด้วย ซึ่งนำไปคำนวณหาอัตราการกัดกร่อน แสดงดังรูปที่ 2 ในขณะเดียวกันถ้าโลหะที่มีฟิล์มพาสซีพ (passive film) ที่ทนต่อการกัดกร่อน เช่น เหล็กกล้าไร้สนิม ถ้าป้อนศักย์ไฟฟ้าต่อไปอีกโลหะนั้นสร้างฟิล์มพาสซีพ (passive film) เพื่อป้องการการกัดกร่อนทำให้ค่ากระแสไฟฟ้าคงที่หรือลดลง ในขณะเมื่อที่ป้อนศักย์ไฟฟ้าเพิ่มขึ้นจนถึงระดับหนึ่งที่ทำให้ค่ากระแสไฟฟ้าเริ่มเพิ่มขึ้นอีกครั้ง แสดงว่าเกิดการแตกของฟิล์มพาสซีพ (passive film) เป็นรูเข็ม (pitting) นั่นคือค่าศักย์ไฟฟ้าที่เกิดการกัดกร่อนแบบรูเข็ม (pitting potential, Ep) และค่ากระแสไฟฟ้าพาสซีพ (passive current density, Ip) แสดงดังรูปที่ 3

รูปที่ 2 เส้นโค้งโพลาไรเซชันสำหรับการกัดกร่อน แบบทั่วผิวหน้าของโลหะ (ASTM G 3)

รูปที่ 3 เส้นโค้งโพลาไรเซชันสำหรับการกัดกร่อนที่เกิดฟิล์มพาสซีพ (passive film) คลุมทั่วผิวหน้าโลหะ (ASTM G 3)
ลักษณะของเส้นโค้งโพลาไรเซชัน (polarization curve) แสดงพฤติกรรมการกัดกร่อนของโลหะมีรายละเอียดดังนี้
- ค่าศักย์ไฟฟ้าการกัดกร่อน (corrosion potential, Ecorr) เป็นค่าศักย์ไฟฟ้าที่โลหะเริ่มเกิดการกัดกร่อน ซึ่งถ้าโลหะที่มีค่าศักย์ไฟฟ้าการกัดกร่อนต่ำจะไวต่อการกัดกร่อนมากกว่าโลหะที่มีค่าศักย์ไฟฟ้าการกัดกร่อนสูง
- ค่าความหนาแน่นของกระแสไฟฟ้าการกัดกร่อน (corrosion current density, Icorr) เป็นค่าความหนาแน่นกระแสไฟฟ้าที่เกิดขึ้นที่จุดเกิด Ecorr โดยค่า Icorr แสดงถึงการกัดกร่อนแบบทั่วผิวหน้า (uniform corrosion) และสามารถนำมาคำนวณหาค่าอัตราการกัดกร่อนแบบทั่วผิวหน้าต่อปีของตัวอย่างทดสอบได้ จากสูตรดังนี้
อัตราการกัดกร่อน (corrosion rate) =(k x Icorr x EW)/(A x D)
– k คือ ค่าคงที่ของการคำนวณเปลี่ยนหน่วยต่างๆ เช่น มีค่า 13 ถ้าอัตราการกัดกร่อนมีหน่วย มิลต่อปี (mil per year, mpy) หรือมีค่า 0.00327 ถ้าหน่วย มิลลิเมตรต่อปี (millimeter per year, mm/y)
– Icorr คือ ค่าความหนาแน่นของกระแสไฟฟ้าการกัดกร่อน (corrosion current density) หน่วยเป็นไมโครแอมป์ต่อตารางเซนติเมตร (µA/cm2)
– EW คือ ค่ามวลสมมูล (equivalent Weight) ของโลหะตัวอย่างที่ผ่านการทดสอบ ถ้าโลหะผสมต้องคำนวณตามสัดส่วน
– A คือ พื้นที่ผิวของโลหะตัวอย่าง หน่วยเป็นตารางเซนติเมตร (cm2)
– D คือ ความหนาแน่นของโลหะตัวอย่าง หน่วยเป็น กรัมต่อลูกบาศก์เซนติเมตร (g/cm3)
- ค่าศักย์ไฟฟ้าขณะที่เกิดฟิล์มที่ผิว (primary passivation potential, Epp) เป็นค่าศักย์ไฟฟ้าที่โลหะเกิดฟิล์มพาสซีพ (passive film) คลุมทั่วผิวหน้าโลหะ ซึ่งมีผลให้เกิดการกัดกร่อนน้อยลง
- ค่าศักย์ไฟฟ้าที่เกิดการกัดกร่อนแบบรูเข็ม (pitting potential, Ep) เป็นค่าศักย์ไฟฟ้าที่โลหะเกิดการกัดกร่อนแบบรูเข็ม (pitting) ซึ่งพบในโลหะที่สามารถสร้างฟิล์มพาสซีพ (passive film) ที่ทนต่อการกัดกร่อน เช่น เหล็กกล้าไร้สนิม
ตัวอย่าง เส้นโค้งโพลาไรเซชัน (polarization curve) และประเมินผลของการทดสอบแผ่นอะลูมิเนียมในสารละลายกรดซัลฟิวริก (Sulfuric acid, 1N H2SO4) รายละเอียดแสดงดังรูปที่ 4

จากเส้นโค้งโพลาไรเซซัน (polarization curve) ประเมินผลได้ดังนี้
– ค่าศักย์ไฟฟ้าการกัดกร่อน (corrosion potential, Ecorr) = – 0.142 V
– ค่าความหนาแน่นของกระแสไฟฟ้าการกัดกร่อน (corrosion current density, Icorr) = 81 µA/ cm2
ข้อมูลของโลหะตัวอย่าง
– ค่ามวลสมมูล (equivalent weight) ของอะลูมิเนียม = 99 g.
– พื้นที่ผิวของโลหะตัวอย่าง = 1 cm2
– ความหนาแน่นของอะลูมิเนียม = 7 g/cm3
คำนวณหาอัตราการกัดกร่อน (corrosion rate) =(k x Icorr x EW)/(A x D)
– อัตราการกัดกร่อนของอะลูมิเนียม = 0.15 mm/y
รูปที่ 4 เส้นโค้งโพลาไรเซชัน (polarization curve) ของการกัดกร่อนของแผ่นอะลูมิเนียมในสารละลายกรดซัลฟิวริก (Sulfuric acid, 1N H2SO4) และอัตราการกัดกร่อนของอะลูมิเนียม
ตัวอย่างเส้นโค้งโพลาไรเซชัน (polarization curve) ที่เกิดฟิล์มพาสซีพ (passive film) และประเมินผลค่าศักย์ไฟฟ้าที่ทำให้เกิดการกัดแบบรูเข็ม จากการทดสอบแผ่นสแตนเลส ทดสอบในสารละลายโซเดียมคลอไรด์ (5%NaCl) แสดงดังรูปที่ 5

จากเส้นโค้งโพลาไรเซซัน (polarization curve) ที่เกิดฟิล์มพาสซีพ (passive film) ประเมินผลได้ดังนี้
ค่าศักย์ไฟฟ้าที่ทำให้เกิดการกัดกร่อนแบบรูเข็ม (pitting potential, Ep) = 0.12 V
รูปที่ 5 เส้นโค้งโพลาไรเซชัน (polarization curve) ของการกัดกร่อนของแผ่นสแตนเลส ในสารละลายโซเดียมคลอไรด์ (5% NaCl) ที่เกิดฟิล์มพาสซีพ (passive film)
ผลการประเมินการกัดกร่อนของโลหะจากเส้นโค้งโพลาไรเซชัน (polarization curve) ถ้าโลหะที่มีค่าศักย์ไฟฟ้าการกัดกร่อน (Ecorr ) ต่ำ จะไวต่อการกัดกร่อนมากกว่าโลหะที่มีค่าศักย์ไฟฟ้าการกัดกร่อน (Ecorr ) สูง และคำนวณหาอัตราการกัดกร่อนของโลหะต่อปีได้จากค่าความหนาแน่นของกระแสไฟฟ้าการกัดกร่อน (Icorr) ดังนั้นการทดสอบการกัดกร่อนโลหะโดยเทคนิคเคมีไฟฟ้า (electrochemical test) เป็นวิธีหนึ่งที่สามารถศึกษาพฤติกรรมการกัดกร่อนของโลหะได้ ใช้เวลาน้อย เพื่อช่วยให้การเลือกวัสดุให้เหมาะสมกับงานหรือสามารถหาวิธีป้องกันการกัดกร่อนได้ดี
เอกสารอ้างอิง
การกัดกร่อนและการเลือกใช้วัสดุ โดย รศ. ศิริลักษณ์ นิวิฐจรรยงค์ ภาควิชาเคมีอุตสาหการ คณะวิทยาศาสตร์ประยุกต์ สถาบันเทคโนโลยีพระจอมเกล้าพระนครเหนือพิมพ์ครั้งที่ 1 พ.ศ. 2545
Standard Practice for Convention Applicable to Electrochemical Measurements in Corrosion Testing1, ASTM G 3 – 89 (reapproved 2004)
Standard Practice for Calculation of Corrosion Rate and Related information from Electrochemical Measurements1, ASTM G 102 – 89 (reapproved 2004)E1
คู่มือการใช้เครื่อง Potentiostat/Galvanostat


Leave a Reply